一、包材相容性研究
·针对安瓿、西林瓶和胶塞等药品包装系统设计相容性研究方案,辅助药品申报。
·采用半定量扫描方法对药包材中的添加剂进行提取研究,包括抗氧剂、增塑剂、硫化剂、润滑剂等。
·对“高关注毒性物质”进行重点关注,并进行毒理学评价,包括多环芳烃类(PAHs)、2-巯基苯并噻唑(2-MBT)、亚硝胺类等。
·对不同给药途径的制剂采用特异性的元素杂质检测方案。
二、药物质量研究
·起始原料方法开发及验证,质量标准建立。
·关键中间体质量控制和标准建立。
·合成工艺研究中的中控数据采集。
·原料药质量研究和标准建立:有关物质、光学异构体、含量、残留溶剂、基因毒性杂质、元素杂质、粒径研究测定方法的开发与验证及结构确证、理化检测。
·制剂质量研究和标准建立:有关物质、光学异构体、含量、残留溶剂、基因毒性杂质、元素杂质、粒径研究测定方法的开发与验证及结构确证、理化检测、不溶性微粒、相关剂型的一般检测项的检验、影响因素试验、加速试验、长期试验、中间条件试验、冻融试验。
三、痕量残留物分析
·通过GC(MS、FID、ECD),LC-MS,LC-MS-MS ,ICP-MS等技术对起始物料、中间体、原料药和制剂中的杂质进行定量研究。
·色谱与质谱联用进行微量杂质(如基因毒性杂质)的方法开发验证及检测服务。
·残留溶剂方法开发验证及检测服务。
·ICPMS 技术进行微量金属杂质及包材相容性的研究。
四、分离纯化及鉴定
·通过分析型SFC(PDA、ELSD)仪器和制备型SFC仪器对手性化合物进行方法筛选与拆分。
·通过分析型LCMS及制备与半制备色谱仪对杂质进行定性分析及制备。
·使用核磁共振、红外吸收光谱仪、质谱仪对样品进行数据采集及结构解析与确认。
五、注射剂一致性评价
·处方考察:处方组成及处方用量、配伍溶液种类筛选及配伍溶液稳定性等。
·工艺研究:除菌,除热源工艺研究、溶液配制、灭菌工艺研究等。
·质量研究:根据注射剂的CQA进行质量研究。
·包材相容性:包括直接接触药品的包材、给药器械及附件(如喷雾泵、输液软管)等的相容性等。
·稳定性研究:低温冻融试验、影响因素试验、长期试验、加速试验、中间条件试验。
六、基因毒性&元素杂质
·杂质谱分析
·杂质的分离鉴定
·杂质的合成与表征
·分析方法开发与验证
·放行检测
根据ICH法规要求,一般任何一个分析方法需要经过验证后,才可以用于放行检测,根据检测的目的将药物分析方法分为鉴别、杂质分析和含量测定三类,药物分析中通过供试品与标准物质的直接比较,利用药物的固有性质证明供试品中含有该药物分子。
七、药品研发
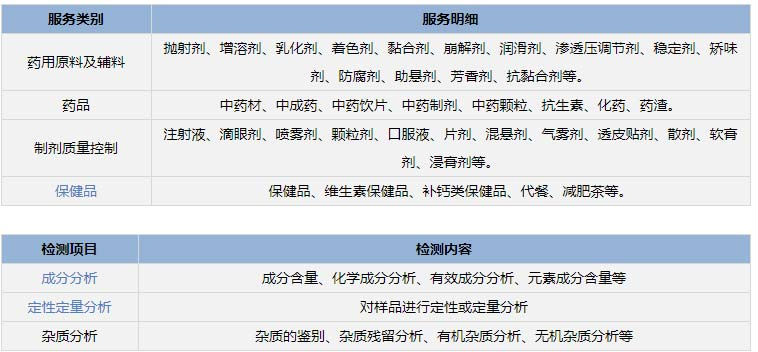
八、溶剂残留检测
一)溶剂残留方法学验证
1、专属性。确认各测定的成分之间都达到基线分离,溶剂系统、内标物质之间应该没有相互干扰的现象。
2、线性。一般采用测定成分在限度值的1~150%范围内的线性。
3、准确度。一般选用测定成分限度的1~150%范围内的回收率进行评价。对于残留溶剂的回收率在80~120%范围内。
4、精密度。重复性,在限度值的50~150%范围内,测定成分的回收率的相对标准差。中间精密度,多个试验者、多根试验用色谱柱、改变试验日期等各种因素进行6次以上的试验,从不同试验日的方差分析结果来评价中间精密度。重现性,在不同的实验室进行试验,看测定结果的偏差,用上面两者一样的判定标准即可。
5、检测限。主要考察各待测成分在仪器上面相应的最低量相应。
6、定量限
7、耐用性
二)检测项目
苯、二氧六环、醋酸、甲基异丁基酮、丙酮、异丁醇、乙二醇、正戊烷、正丁醇、 正戊醇等。
三)检测范围

九、微生物检测及方法验证
① 微生物限度检查方法验证
简介:微生物限度检查法系检查非规定灭菌制剂及其原料、辅料受微生物污染程度的方法。检查项目包括细菌数、霉菌数、酵母菌数及控制菌检查
验证内容:细菌、霉菌和酵母菌计数方法验证;控制菌方法验证。
检测项目:细菌、霉菌及酵母菌计数、大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、沙门氏菌。
② 抑菌效率验证
简介:产企业在研发阶段制剂中抑菌剂浓度的确定。抑菌剂的抑菌效力在贮存过程中有可能因药物的成分或包装容器等因素影响而变化,因此,应验证成品制剂的抑菌效力在效期内不因贮藏条件而降低。
检测项目:萄球菌 、铜绿假单胞菌、大肠埃希菌、白色念珠菌、黑曲霉。
③ 细菌内毒素检验方法验证
简介:本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。本试验操作过程应防止内毒素的污染。
验证内容:鲎试剂灵敏度复核试验、干扰试验。
十、中药材有毒有害物质检测

十一、医疗器械检测
检测产品
一、医用口罩、医用防护服、医用护目镜、体温计等医用防护产品
二、植入医疗器械分类:
1、有源植入医疗器械:按照临床使用领域的不同分为4个产品类别,分别为心脏节律管理设备(例如植入式心脏起搏器)、神经调控设备(例如植入式迷走神经刺激器)、辅助位听觉设备(例如人工耳蜗植入体)和其他(例如植入式药物泵)。
2、无源植入医疗器械:按照临床使用领域的不同可以分为眼科医疗器械、口腔科医疗器械、妇产科医疗器械、骨接合植入物、运动损伤软组织修复重建及置换植入物、脊柱植入物、关节置换植入物、骨科填充和修复材料、神经内/外科植入物、心血管植入物、耳鼻喉植入物、整形及普通外科植入物、组织工程支架材料、其他等医疗器械产品。
检测范围

十二、晶型控制
同一种药物由于其结晶结构不同,而形成了不同的多晶型物从而出现多晶型现象。研究药物的多晶型现象的工作,当前已成为日常控制药物生产和新药剂型确定前设计所不可缺的重要组成部分。
对于固体药物而言,不同晶型的同种药物,其理化性质如稳定性、溶解性、吸湿性、形状、颜色、流动性、密度等可能存在显著差异,因此有时可能会在大批量生产或制剂过程中产生不同程度影响;更主要的是,不同质异晶有时会在生物利用度、药效等方面可能会存在显著区别。比如具有3种多晶型的磺胺-5-甲氧基嘧啶,II型具有更高的生物利用度。
1、晶型物质的绝对构型鉴别:单晶X射线衍射法(SXRD),得到供试品的成分组成、构型、晶胞参数、晶系空间群等信息。
2、相对鉴别方法:借助已知的晶型信息对未知供试品进行对比分析判断,比如已知构型的对照品或对照品的谱图比对。具体方法如下。
① X-射线衍射法(XRD):研究药物晶型的主要手段,晶型鉴别时利用供试品衍射峰的位置(2θ)、强度、各峰强度之比等参量化实现对晶型物质状态的鉴别。
② 红外吸收光谱法(FTIR):不同晶型药物分子中的某些化学键键长、键角会有所不同,致使其振动-转动跃迁能级不同,与其相应的红外光谱的某些主要特征如吸收带频率、峰形、峰位、峰强度等也会出现差异,因此红外光谱可用于药物多晶型研究。
③ 拉曼光谱法(RM):利用供试品不同晶型物质特有的分子极化率变化,引起指定波长范围的拉曼光谱吸收峰的位置、强度、峰形几何拓扑等参量变化实现对晶型物质状态的鉴别。
④ 差示扫描量热法(DSC):利用供试品不同晶型物质特有的热力学性质,通过供试品吸热峰或放热峰的数量、位置等参量变化实现对晶型物质状态的鉴别。方法适用于不同晶型物质的熔融吸热峰值存在一定差异或供试品中含有不同数量和种类结晶溶剂(或水)的晶型物质的鉴别。
⑤ 热重法(TGA):利用供试品不同晶型物质特有的失重百分率与温度关系参量的变化实现对晶型物质状态的鉴别。方法适用于供试品中含有不同数量和种类结晶溶剂(或水)的晶型物质的鉴别。
⑥ 偏光显微镜法::透明固体药物的观测一般是在正交偏光下进行。由于晶体结构不同和偏光射入时的双折射作用,在偏光显微镜上、下偏光镜的正交作用下,晶体样品置于载物台上旋转360º时,则晶体显现短暂的隐失和闪亮,晶体隐失时晶体与偏振器振动力向所成的交角称为消光角,通过供试品同标准品消光角对比,判断供试品晶型。
十三、反向工程研究
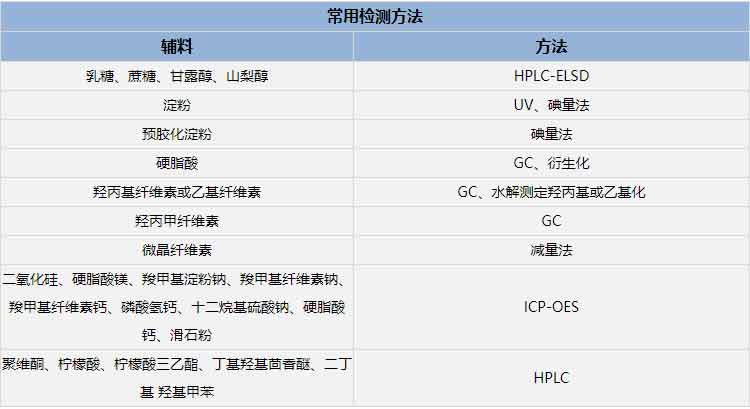
反向工程研究是通过对原研药进行逆向分析,得知辅料的含量及制备工艺等关键性指标。对于注射剂而言,《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》要求:“注射剂仿制药中的辅料种类和用量通常应与参比制剂相同。辅料的用量相同是指仿制药辅料用量为参比制剂相应辅料用量的95%-105%。”依据文献确定辅料用量药监部门难以认可,仿制注射剂需要准确测定原研制剂的辅料用量。对于固体制剂而言,反向工程研究可以降低制剂开发的难度、减少处方开发的工作量、缩短研发的时间,提高BE的通过率。
服务项目:单组份或多组份生物分析方法建立、完整或部分生物分析方法学建立、体外样品分析、体内样品分析等。
检测范围
1、注射剂
研究流程:通过调研美国、欧盟、日本、阿根廷等国家药监部门官网,确定辅料组成和部分辅料用量;通过检测的方法,确定辅料用量。
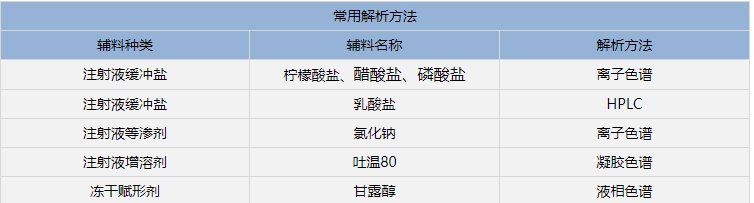
2、固体制剂
研究流程:通过调研美国、欧盟、日本、阿根廷等国家药监部门官网,确定辅料组成和部分辅料用量;通过检测的方法,确定辅料用量;通过电镜扫描和处方,确定制剂工艺;通过X射线衍射等方法,确定仿制产品与原研制剂晶型是否一致。